semeater 1
SIFAT SENYAWA ION
1.Struktur/susunan kristal
 Dalam
keadaan padat, senyawa ionis terdapat dalam bentuk kristal dengan
susunan tertentu. Penafsiran terhadap hasil difraksi sinar-X pada
senyawa ion dapat memberi petunjuk mengenai susunan internal dari
kristal ion tersebut. Misalnya pada kristal NaCl dapat diketahui bahwa
setiap ion Na+ dikelilingi oleh 6 ion Cl-, dan setiap ion Cl- juga
dikelilingi oleh 6 ion Na+.
Dalam
keadaan padat, senyawa ionis terdapat dalam bentuk kristal dengan
susunan tertentu. Penafsiran terhadap hasil difraksi sinar-X pada
senyawa ion dapat memberi petunjuk mengenai susunan internal dari
kristal ion tersebut. Misalnya pada kristal NaCl dapat diketahui bahwa
setiap ion Na+ dikelilingi oleh 6 ion Cl-, dan setiap ion Cl- juga
dikelilingi oleh 6 ion Na+.
2. Keras, kaku dan rapuh
3. Reaksi ion
Pada reaksi senyawa ionis, ion-ion tidak tergantung
pada ion pasangannya, misalnya bila NaCl dan AgNO3 (dalam larutan)
dicampurkan, maka segera terbentuk endapan AgCl. Reaksi yang terjadi
adalah:
Ag+(aq) + Cl-(aq)  AgCl (s)
AgCl (s)
4. Daya hantar listrik
Baik dalam keadaan cair (meleleh) maupun dalam larutannya senyawa ionis dapat menghantarkan arus listrik.
 Pada
table 1.1 dapat dilihat daya hantar berbagai senyawa klorida dalam
keadaan padatan, cair (meleleh) pada suhu titik lelehnya dan pada
larutannya
5. Isomorf
Senyawa-senyawa ion yang mempunyai susunan yang mirip
satu sama lain seperti NaCl dan KNO3 mempunyai bentuk kristal yang sama
yang disebut isomorf. Di samping itu terdapat pula senyawa-senyawa yang
mempunyai muatan ion berbeda, tetapi mempunyai susunan kristal yang
sama, misalnya NaF dan MgO, CaCl2 dan K2S masing-masing mempunyai
susunan kristal yang sama.
5. Kelarutan
Pada
table 1.1 dapat dilihat daya hantar berbagai senyawa klorida dalam
keadaan padatan, cair (meleleh) pada suhu titik lelehnya dan pada
larutannya
5. Isomorf
Senyawa-senyawa ion yang mempunyai susunan yang mirip
satu sama lain seperti NaCl dan KNO3 mempunyai bentuk kristal yang sama
yang disebut isomorf. Di samping itu terdapat pula senyawa-senyawa yang
mempunyai muatan ion berbeda, tetapi mempunyai susunan kristal yang
sama, misalnya NaF dan MgO, CaCl2 dan K2S masing-masing mempunyai
susunan kristal yang sama.
5. Kelarutan
 Pada
umumnya senyawa ionis larut dalam pelarut yang mengandung gugs OH-
seperti H2O dan C2H5OH yang merupakan senyawa kovalen polar, sedangkan
senyawa kovalen larut dalam pelarut nonpol
IKATAN KOPALEN
Pada
umumnya senyawa ionis larut dalam pelarut yang mengandung gugs OH-
seperti H2O dan C2H5OH yang merupakan senyawa kovalen polar, sedangkan
senyawa kovalen larut dalam pelarut nonpol
IKATAN KOPALEN
Proses pembentukan kestabilan suatu atom tidak hanya melalui
pelepasan dan penerimaan elektron, kenyataan kestabilan juga dapat
dicapai dengan cara menggunakan elektron secara bersama. Bagaimana satu
atom dapat menggunakan elektron terluarnya secara bersama dapat dilihat
pada Gambar 5.6.
Gambar 5.6. Pasangan elektron bersama untuk atom F yang membentuk senyawa F2
Atom Flor, memiliki nomor atom 7, sehingga memiliki 7 (tujuh)
elektron yang berada pada dua tingkat energi yaitu energi pertama (kulit
K) dan tingkat energi kedua yaitu kulit L, elektron terdistribusi pada
orbital 1s2, 2s2 dan orbital p5, seperti Gambar 5.6. Pada orbital p, dua
elektron dibedakan (biru gelap) berasal dari atom F sebelah kiri dan
kanan, kedua atom itu dipergunakan agar konfigurasinya mengikuti gas
mulia. Gambar 5.7 A dan B, menunjukkan ikatan kovalen dari senyawa H2,
dan adanya gaya tarik kovalen dari setiap inti atom H terhadap pasangan
elektron, dan dapat ditarik kesimpulan bahwa gaya tarik-menarik bersih
(netto) yang terjadi ketika setiap atom memberikan 1 (satu) elektron
tidak berpasangan untuk dipasangkan dengan elektron dari atom yang lain,
pada satu ruang kosong, maka pasangan elektron ditarik oleh kedua inti
atom tersebut.
Gambar 5.7. Ikatan kovalen yang terjadi pada atom H membentuk H2, dengan menggunakan elektron bersama dari orbital 1s1
Ikatan kovalen terjadi karena atom-atom yang berikatan memiliki
kelektronegatifan yang setara dan tidak memiliki kelebihan orbital
kosong yang berenergi rendah.
Kondisi semacam ini tampak pada unsur-unsur non logam, paling tidak
terdapat antara 4 (elektron) sampai 8 (delapan) elektron yang berada
pada kulit terluar. Beberapa pengecualian perlu diperhatikan khususnya
untuk unsur H (hidrogen) elektron valensi 1s1 (satu elektron pada
tingkat energi terendah, (Helium) elektron 1s2 (dua elektron pada
tingkat energi terendah. Demikianpula untuk B (Boron) memiliki 3
elektron valensi (2s2, 2p1), sehingga unsur non logam cenderung
membentuk ikatan kovalen.
Beberapa unsur non logam yang membentuk senyawa kovalen seperti,
Hidrogen (H), Karbon (C), Nitrogen(N), Oksigen (O), Posfor (P), Sulfur
atau Belerang (S) dan Selenium (Se). Atas dasar kemampuan menarik atau
melepas elektron, umumnya muatan dari unsur-unsur non logam adalah +4,
-4, -3, -2 dan -1.
Panggambaran ikatan kovalen didasari pada kaidah oktet (delapan) atau
octet rule, menurut kaidah ini elektron valensi berjumlah delapan (s2
dan p6) sebagai bentuk kestabilan dari konfigurasi gas mulia, sehingga
jumlah 8 (delapan) elektron merupakan jumlah yang harus dipenuhi untuk
membentuk ikatan kovalen, kecuali untuk hidrogen hanya dua elektron.
Lewis memperkenalkan cara penulisan ikatan dan senyawa kovalen, pasangan
elektron yang dipergunakan bersama digambarkan sebagai garis lurus.
Gambar 5.8, menjelaskan dan menyederhanakan cara penulisan dan
penggambaran senyawa kovalen untuk beberapa senyawa kovalen yang
dibentuk dari atom yang berbeda.
Gambar 5.8. Ikatan molekul dengan atom penyusun yang berbeda atom H dan O, membentuk senyawa air
Ikatan kovalen dapat terbentuk dari beberapa pasangan elektron,
seperti tunggal contohnya F2 atau H2, namun dapat pula terjadi rangkap
dua seperti pada molekul gas CO2, dan rangkap tiga terjadi gas astilen
C2H2.
Pada molekul CO2, atom Karbon menyumbangkan 2 (dua) elektron untuk
setiap atom oksigen, demikianpula dengan atom oksigen masing-masing
memberikan 2 (dua) elektronnya.
Untuk molekul C2H2, dua atom Karbon saling memberikan 3 (tiga
elektronnya) sehingga terjadi tiga pasangan elektron, dan setiap atom
Karbon juga menyumbangkan satu elektronnya ke atom hidrogen, sedangkan
kedua atom hidrogen, masing-masing memberikan satu elektronnya kepada
karbon dan membentuk 2 (dua) pasangan elektron, perhatikan Gambar 5.9.
Gambar 5.9. Ikatan kovalen rangkap dua pada senyawa CO2 dan rangkap tiga pada senyawa C2H2
Secara teliti, jika kita amati ikatan kovalen antara dua atom yang
berbeda akan terlihat bahwa salah satu inti atom lebih besar dari atom
yang lainnya, misalnya air, yang disusun oleh satu atom oksigen dan dua
atom H, seperti pada Gambar 5.10. Inti atom oksigen jauh lebih besar dan
jumlah muatan protonnya juga lebih banyak, sehingga 2 pasang dari
pasangan elektron yang dibentuk oleh atom H dan O akan lebih tertarik ke
inti atom oksigen. Hal ini menyebabkan, atom oksigen lebih bermuatan
negatif dan masing-masing atom hidrogen akan bermuatan sedikit postif,
dengan demikian terjadi polarisasi muatan dalam senyawa tersebut, dan
terbentuk dua kutub (positif dan negatif) atau dipol.
Gambar 5.10. Momen dipol dan sebaran muatan parsial negatif yang
ditunjukkan arah resultante momen dipol untuk molekul H2O, SO2 dan CO2
Perbedaan muatan untuk senyawa dipol dinyatakan dalam momen dipol.
Perhitungan momen dipol didasari atas perbedaan keelektronegatifan dari
atom-atom penyusunnya. Secara kualitatif kita dapat memprediksi
terjadinya polarisasi muatan dan resultante momen dipol yang dapat
dipergunakan untuk melihat sebaran dari muatan parsial positif dan
parsial negatif, seperti yang ditunjukkan oleh molekul air, sulfur
dioksida dan karbondioksida pada Gambar 5.10. Dari gambar tampak bahwa
untuk molekul air muatan parsial negatif terakumulasi di atom Oksigen,
sama halnya dengan molekul sulfurdioksida. Berbeda dengan seyawa CO2
tidak terjadi polarisasi.
Ikatan kovalen yang memiliki bentuk lain juga diamati, dimana ikatan
terbentuk akibat sebuah senyawa memiliki sepasang elektron yang tidak
dipergunakan (pasangan elektron bebas) disumbangkan kepada sebuah ion
atau senyawa, ikatan ini disebut juga dengan ikatan kovalen koordinasi.
Contoh menarik yang dapat kita temui adalah pembentukan ion amonium dan
pembentukan senyawa BF3NH3.
Molekul NH3 terpusat pada atom Nitrogen yang memiliki 5 (lima)
elektron valensi, 2 elektron pada orbital s (2s2) dan 3 elektron pada
orbital p (2p3). Tiga elektron pada orbital p dari Nitrogen membentuk
pasangan electron dengan 3 elektron dari atom H masing-masing memiliki
satu elektron, elektron valensi orbital s atom Nitrogen belum
dipergunakan, dan disebut dengan pasangan elektron bebas. Pasangan
elektron bebas hanya dapat disumbangkan kepada ion yang kekurangan
elektron, misalnya ion H+ atau molekul Boron triflorida BF3.
Kita ketahui bahwa atom memiliki satu buah proton dan satu buah
elektron, atom H akan berubah menjadi ion H+, jika melepaskan
elektronnya, sehingga orbital 1s-nya tidak berisi elektron, dan orbital s
inilah yang akan menerima sumbangan dari pasangan elektron bebas dari
senyawa NH3. Dengan diterimanya elektron dari senyawa NH3, maka
konfigurasi ion H+ memiliki dua elektron. Bagan reaksi 5.11,
menyederhanakan terjadinya ikatan kovalen koordinasi.
Bagan 5.11. Bagan reaksi proses pembentukan ikatan kovalen
koordinasi, (a) pembentukan ion H+ dari atom H dan (b) NH3 menyumbang
elektron bebasnya membentuk ion amonium (NH4)+
Sedangkan untuk molekul NH3BF3, pasangan elektron bebas diberikan
kepada atom pusat molekul BF3 yaitu B (Boron). Atom ini memiliki
memiliki elektron valensi 2s2 dan 2p1. Pembentukan molekul BF3 cukup
unik, pertama-tama elektron pada orbital s berpindah ke orbital p,
sehingga konfigurasi yang lebih teliti adalah 2s1, 2px1, 2py1 dan 2pz0
masih tetap kosong. Orbital yang berisi satu elektron ini dipergunakan
secara bersama dengan 3 (tiga) atom F, sehingga membentuk ikatan
kovalen. Atom B masih memiliki orbital kosongnya yaitu 2pz0 dan orbital
inilah yang menerima sumbangan pasangan elektron bebas dari molekul NH3
dan membentuk membentuk ikatan kovalen koordinasi dari molekul NH3BF3.
Proses pembentukannya dapat dilihat pada Bagan 5.12.
Bagan 5.12. Bagan reaksi proses pembentukan ikatan kovalen BF3 dan ikatan kovalen koordinasi antara molekul NH3 dan molekul BF3
Dalam ikatan kovalen dapat pula membentuk ion, misalnya ion
hidroksida (OH)- ion ini terbentuk karena terjadi pasangan elektron
antara atom H dan O, namun oksigen memiliki kelebihan elektron sebanyak
satu buah, dan menyebabkan terbentuknya ion (OH)-. Contoh lain adalah
ion Carbonat (CO3)2-, yang terbentuk dari satu ikatan rangkap dua antara
atom C dengan O, dan dua ikatan tunggal antara atom C dengan atom O,
namun 2 atom oksigen kelebihan masing-masing satu elektron, sehingga ion
ini kebihan 2 muatan negatif. Pembentukan anion untuk senyawa dengan
ikatan kovalen ditunjukkan pada Gambar 5.13.
Gambar 5.13. Anion hidroksida (OH)- dan carbonat (CO3) 2-yang dibentuk melalui ikatan kovalen
Dari tinjauan energi, pembentukan ikatan kimia melalui ikatan kovalen
merupakan reaksi eksoterm, berbeda dengan ikatan ion yang justru
membutuhkan energi (endoterm), dan umumnya reaksi eksoterm berlangsung
secara spontan, sehingga senyawa yang dibentuk oleh ikatan kovalen lebih
banyak dibandingkan dengan senyawa yang dibentuk oleh ikatan ion.
Molekul yang membangun sel makhluk hidup berupa protein, lemak,
karbohidrat merupakan contoh molekul atau senyawa yang dibentuk oleh
ikatan kovalen.
PERKEMBANGAN TEORI ATOM
1. Teori Atom John Dalton
Pada tahun 1803, John Dalton mengemukakan mengemukakan pendapatnaya
tentang atom. Teori atom Dalton didasarkan pada dua hukum, yaitu hukum
kekekalan massa (hukum Lavoisier) dan hukum susunan tetap (hukum
prouts). Lavosier mennyatakan bahwa “Massa total zat-zat sebelum reaksi
akan selalu sama dengan massa total zat-zat hasil reaksi”. Sedangkan
Prouts menyatakan bahwa “Perbandingan massa unsur-unsur dalam suatu
senyawa selalu tetap”. Dari kedua hukum tersebut Dalton mengemukakan
pendapatnya tentang atom sebagai berikut:
- Atom merupakan bagian terkecil dari materi yang sudah tidak dapat dibagi lagi
- Atom digambarkan sebagai bola pejal yang sangat kecil, suatu unsur
memiliki atom-atom yang identik dan berbeda untuk unsur yang berbeda
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan
bulat dan sederhana. Misalnya air terdiri atom-atom hidrogen dan
atom-atom oksigen
- Reaksi kimia merupakan pemisahan atau penggabungan atau penyusunan
kembali dari atom-atom, sehingga atom tidak dapat diciptakan atau
dimusnahkan.
Hipotesa Dalton digambarkan dengan model atom sebagai bola pejal seperti pada tolak peluru. Seperti gambar berikut ini:
Kelemahan:
Teori dalton tidak menerangkan hubungan antara larutan senyawa dan daya hantar arus listrik.
2. Teori Atom J. J. Thomson
Berdasarkan penemuan tabung katode yang lebih baik oleh William Crookers, maka J.J. Thomson meneliti
lebih lanjut tentang sinar katode dan dapat dipastikan bahwa sinar
katode merupakan partikel, sebab dapat memutar baling-baling yang
diletakkan diantara katode dan anode. Dari hasil percobaan ini, Thomson
menyatakan bahwa sinar katode merupakan partikel penyusun atom (partikel
subatom) yang bermuatan negatif dan selanjutnya disebut elektron.
Atom merupakan partikel yang bersifat netral, oleh karena elektron
bermuatan negatif, maka harus ada partikel lain yang bermuatan
positifuntuk menetrallkan muatan negatif elektron tersebut. Dari
penemuannya tersebut, Thomson memperbaiki kelemahan dari teori atom
dalton dan mengemukakan teori atomnya yang dikenal sebagai Teori Atom
Thomson. Yang menyatakan bahwa:
“Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron”
Model atomini dapat digambarkan sebagai jambu biji yang sudah
dikelupas kulitnya. biji jambu menggambarkan elektron yang tersebar
marata dalam bola daging jambu yang pejal, yang pada model atom Thomson
dianalogikan sebagai bola positif yang pejal. Model atom Thomson dapat
digambarkan sebagai berikut:
Kelemahan:
Kelemahan model atom Thomson ini tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
3. Teori Atom Rutherford
Rutherford bersama dua orang muridnya (Hans Geigerdan Erners Masreden)
melakukan percobaan yang dikenal dengan hamburan sinar alfa (λ)
terhadap lempeng tipis emas. Sebelumya telah ditemukan adanya partikel
alfa, yaitu partikel yang bermuatan positif dan bergerak lurus, berdaya
tembus besar sehingga dapat menembus lembaran tipis kertas. Percobaan
tersebut sebenarnya bertujuan untuk menguji pendapat Thomson, yakni
apakah atom itu betul-betul merupakan bola pejal yang positif yang bila
dikenai partikel alfa akan dipantulkan atau dibelokkan. Dari pengamatan
mereka, didapatkan fakta bahwa apabila partikel alfa ditembakkan pada
lempeng emas yang sangat tipis, maka sebagian besar partikel alfa
diteruskan (ada penyimpangan sudut kurang dari 1°), tetapi dari
pengamatan Marsden diperoleh fakta bahwa satu diantara 20.000 partikel
alfa akan membelok sudut 90° bahkan lebih.
Berdasarkan gejala-gejala yang terjadi, diperoleh beberapa kesipulan beberapa berikut:
- Atom bukan merupakan bola pejal, karena hampir semua partikel alfa diteruskan
- Jika lempeng emas tersebut dianggap sebagai satu lapisanatom-atom
emas, maka didalam atom emas terdapat partikel yang sangat kecil yang
bermuatan positif.
- Partikel tersebut merupakan partikelyang menyusun suatu inti atom,
berdasarkan fakta bahwa 1 dari 20.000 partikel alfa akan dibelokkan.
Bila perbandingan 1:20.000 merupakan perbandingan diameter, maka
didapatkan ukuran inti atom kira-kira 10.000 lebih kecil daripada ukuran
atom keseluruhan.
Berdasarkan fakta-fakta yang didapatkan dari percobaan tersebut, Rutherford mengusulkan model atom yang dikenal dengan Model Atom Rutherford yang menyatakan bahwa Atom terdiri dari inti atom yang sangat kecil dan bermuatan positif, dikelilingi oleh elektron yang bermuatan negatif.
Rutherford menduga bahwa didalam inti atom terdapat partikel netral
yang berfungsi mengikat partikel-partikel positif agar tidak saling
tolak menolak.
Model atom Rutherford dapat digambarkan sebagai beriukut:
Kelemahan:
Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom.
4. Teori Atom Bohr
ada tahun 1913, pakar fisika Denmark bernama Neils Bohr
memperbaiki kegagalan atom Rutherford melalui percobaannya tentang
spektrum atom hidrogen. Percobaannya ini berhasil memberikan gambaran
keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan
Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari
Rutherford dan teori kuantum dari Planck, diungkapkan dengan empat
postulat, sebagai berikut:
- Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu
elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak
stasioner (menetap) elektron dan merupakan lintasan melingkar
disekeliling inti.
- Selama elektron berada dalam lintasan stasioner, energi elektron
tetap sehingga tidak ada energi dalam bentuk radiasi yang dipancarkan
maupun diserap.
- Elektron hanya dapat berpindah dari satu lintasan stasioner ke
lintasan stasioner lain. Pada peralihan ini, sejumlah energi tertentu
terlibat, besarnya sesuai dengan persamaan planck, ΔE = hv.
- Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut. Besarnya momentum sudut merupakan kelipatan dari h/2∏ atau nh/2∏, dengan n adalah bilangan bulat dan h tetapan planck.
Menurut model atom bohr, elektron-elektron mengelilingi inti pada lintasan-lintasan tertentu yang disebut kulit elektron atau tingkat energi.
Tingkat energi paling rendah adalah kulit elektron yang terletak paling
dalam, semakin keluar semakin besar nomor kulitnya dan semakin tinggi
tingkat energinya.
Kelemahan:
Model atom ini tidak bisa menjelaskan spektrum warna dari atom berelektron banyak.
5. Teori Atom Modern
Model atom mekanika kuantum dikembangkan oleh Erwin Schrodinger
(1926).Sebelum Erwin Schrodinger, seorang ahli dari Jerman Werner
Heisenberg mengembangkan teori mekanika kuantum yang dikenal dengan
prinsip ketidakpastian yaitu “Tidak mungkin dapat ditentukan kedudukan
dan momentum suatu benda secara seksama pada saat bersamaan, yang dapat
ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu
dari inti atom”.
Daerah ruang di sekitar inti dengan kebolehjadian
untuk mendapatkan elektron disebut orbital. Bentuk dan tingkat energi
orbital dirumuskan oleh Erwin Schrodinger.Erwin Schrodinger memecahkan
suatu persamaan untuk mendapatkan fungsi gelombang untuk menggambarkan
batas kemungkinan ditemukannya elektron dalam tiga dimensi.
Persamaan Schrodinger
x,y dan z
Y
m
ђ
E
V |
= Posisi dalam tiga dimensi
= Fungsi gelombang
= massa
= h/2p dimana h = konstanta plank dan p = 3,14
= Energi total
= Energi potensial |
Model atom dengan orbital lintasan elektron ini
disebut model atom modern atau model atom mekanika kuantum yang berlaku
sampai saat ini, seperti terlihat pada gambar berikut ini.
Awan elektron disekitar inti menunjukan tempat
kebolehjadian elektron. Orbital menggambarkan tingkat energi elektron.
Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan
membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit.Dengan
demikian kulit terdiri dari beberapa sub kulit dan subkulit terdiri
dari beberapa orbital. Walaupun posisi kulitnya sama tetapi posisi
orbitalnya belum tentu sama.
Ciri khas model atom mekanika gelombang
-
Gerakan elektron memiliki sifat gelombang, sehingga lintasannya
(orbitnya) tidak stasioner seperti model Bohr, tetapi mengikuti
penyelesaian kuadrat fungsi gelombang yang disebut orbital (bentuk tiga
dimensi darikebolehjadian paling besar ditemukannya elektron dengan
keadaan tertentu dalam suatu atom)
-
Bentuk dan ukuran orbital bergantung pada harga dari ketiga
bilangan kuantumnya. (Elektron yang menempati orbital dinyatakan dalam
bilangan kuantum tersebut)
-
Posisi elektron sejauh 0,529 Amstrong dari inti H menurut Bohr
bukannya sesuatu yang pasti, tetapi bolehjadi merupakan peluang terbesar
ditemukannya elektron.
SEMESTER 2
Titrasi Asam Basa
Titrasi merupakan suatu metoda untuk menentukan kadar suatu zat
dengan menggunakan zat lain yang sudah dikethaui konsentrasinya. Titrasi
biasanya dibedakan berdasarkan jenis reaksi yang terlibat di dalam
proses titrasi, sebagai contoh bila melibatan reaksi asam basa maka
disebut sebagai titrasi asam basa, titrasi redox untuk titrasi yang
melibatkan reaksi reduksi oksidasi, titrasi kompleksometri untuk titrasi
yang melibatan pembentukan reaksi kompleks dan lain sebagainya. (disini
hanya dibahas tentang titrasi asam basa)
Zat yang akan ditentukan kadarnya disebut sebagai “titrant” dan
biasanya diletakan di dalam Erlenmeyer, sedangkan zat yang telah
diketahui konsentrasinya disebut sebagai “titer” dan biasanya diletakkan
di dalam “buret”. Baik titer maupun titrant biasanya berupa larutan.
Prinsip Titrasi Asam basa
Titrasi asam basa melibatkan asam maupun basa sebagai titer ataupun
titrant. Titrasi asam basa berdasarkan reaksi penetralan. Kadar larutan
asam ditentukan dengan menggunakan larutan basa dan sebaliknya.
Titrant ditambahkan titer sedikit demi sedikit sampai mencapai
keadaan ekuivalen ( artinya secara stoikiometri titrant dan titer tepat
habis bereaksi). Keadaan ini disebut sebagai “titik ekuivalen”.
Pada saat titik ekuivalent ini maka proses titrasi dihentikan,
kemudian kita mencatat volume titer yang diperlukan untuk mencapai
keadaan tersebut. Dengan menggunakan data volume titrant, volume dan
konsentrasi titer maka kita bisa menghitung kadar titrant.
Cara Mengetahui Titik Ekuivalen
Ada dua cara umum untuk menentukan titik ekuivalen pada titrasi asam basa.
1. Memakai pH meter untuk memonitor perubahan pH selama titrasi
dilakukan, kemudian membuat plot antara pH dengan volume titrant untuk
memperoleh kurva titrasi. Titik tengah dari kurva titrasi tersebut
adalah “titik ekuivalent”.
2. Memakai indicator asam basa. Indikator ditambahkan pada titrant
sebelum proses titrasi dilakukan. Indikator ini akan berubah warna
ketika titik ekuivalen terjadi, pada saat inilah titrasi kita hentikan.
Pada umumnya cara kedua dipilih disebabkan kemudahan pengamatan, tidak diperlukan alat tambahan, dan sangat praktis.
Indikator yang dipakai dalam titrasi asam basa adalah indicator yang
perbahan warnanya dipengaruhi oleh pH. Penambahan indicator diusahakan
sesedikit mungkin dan umumnya adalah dua hingga tiga tetes.
Untuk memperoleh ketepatan hasil titrasi maka titik akhir titrasi
dipilih sedekat mungkin dengan titik equivalent, hal ini dapat dilakukan
dengan memilih indicator yang tepat dan sesuai dengan titrasi yang akan
dilakukan.
Keadaan dimana titrasi dihentikan dengan cara melihat perubahan warna indicator disebut sebagai “titik akhir titrasi”.
Rumus Umum Titrasi
Pada saat titik ekuivalen maka mol-ekuivalent asam akan sama dengan
mol-ekuivalent basa, maka hal ini dapat kita tulis sebagai berikut:
mol-ekuivalen asam = mol-ekuivalen basa
Mol-ekuivalen diperoleh dari hasil perkalian antara Normalitas dengan volume maka rumus diatas dapat kita tulis sebagai:
NxV asam = NxV basa
Normalitas diperoleh dari hasil perkalian antara molaritas (M) dengan
jumlah ion H+ pada asam atau jumlah ion OH pada basa, sehingga rumus
diatas menjadi:
nxMxV asam = nxVxM basa
keterangan :
N = Normalitas
V = Volume
M = Molaritas
n = jumlah ion H+ (pada asam) atau OH – (pada basa)
TERMOKIMIA
Termokimia dapat didefinisikan sebagai bagian ilmu
kimia yang mempelajari dinamika atau perubahan reaksi kimia dengan
mengamati panas/termal nya saja. Salah satu terapan ilmu ini dalam
kehidupan sehari-hari ialah reaksi kimia dalam tubuh kita dimana
produksi dari energi-energi yang dibutuhkan atau dikeluarkan untuk semua
tugas yang kita lakukan. Pembakaran dari bahan bakar seperti minyak dan
batu bara dipakai untuk pembangkit listrik. Bensin yang dibakar dalam
mesin mobil akan menghasilkan kekuatan yang menyebabkan mobil berjalan.
Bila kita mempunyai kompor gas berarti kita membakar gas metan (komponen
utama dari gas alam) yang menghasilkan panas untuk memasak. Dan melalui
urutan reaksi yang disebut metabolisme, makanan yang dimakan akan
menghasilkan energi yang kita perlukan untuk tubuh agar berfungsi.
Hampir semua reaksi kimia selalu ada energi yang diambil atau
dikeluarkan. Mari kita periksa terjadinya hal ini dan bagaimana kita
mengetahui adanya perubahan energi.
Penyetaraan Reaksi Redoks dan Sel Volta
Dalam tulisan ini, kita akan mempelajari dasar-dasar reaksi redoks,
mempelajari cara menyetarakan reaksi redoks dengan metode perubahan
bilangan oksidasi dan metode setengah reaksi, serta mempelajari
seluk-beluk tentang sel volta dan aplikasinya dalam kehidupan
sehari-hari.
Reaksi Redoks adalah reaksi yang didalamnya terjadi
perpindahan elektron secara berurutan dari satu spesies kimia ke spesies
kimia lainnya, yang sesungguhnya terdiri atas dua reaksi yang berbeda,
yaitu oksidasi (kehilangan elektron) dan reduksi (memperoleh elektron). Reaksi ini merupakan pasangan, sebab elektron yang hilang pada reaksi oksidasi sama dengan elektron yang diperoleh pada reaksi reduksi. Masing-masing reaksi (oksidasi dan reduksi) disebut reaksi paruh (setengah reaksi), sebab diperlukan dua setengah reaksi ini untuk membentuk sebuah reaksi dan reaksi keseluruhannya disebut reaksi redoks.
Ada tiga definisi yang dapat digunakan untuk oksidasi, yaitu kehilangan elektron, memperoleh oksigen, atau kehilangan hidrogen. Dalam pembahasan ini, kita menggunakan definisi kehilangan elektron. Sementara definisi lainnya berguna saat menjelaskan proses fotosintesis dan pembakaran.
Oksidasi adalah reaksi dimana suatu senyawa kimia
kehilangan elektron selama perubahan dari reaktan menjadi produk.
Sebagai contoh, ketika logam Kalium bereaksi dengan gas Klorin membentuk
garam Kalium Klorida (KCl), logam Kalium kehilangan satu elektron yang
kemudian akan digunakan oleh klorin. Reaksi yang terjadi adalah sebagai
berikut :
K —–> K+ + e-
Ketika Kalium kehilangan elektron, para kimiawan mengatakan bahwa logam Kalium itu telah teroksidasi menjadi kation Kalium.
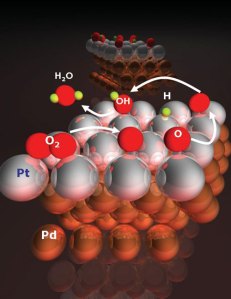 Seperti halnya oksidasi, ada tiga definisi yang dapat digunakan untuk menjelaskan reduksi, yaitu memperoleh elektron, kehilangan oksigen, atau memperoleh hidrogen. Reduksi
sering dilihat sebagai proses memperoleh elektron. Sebagai contoh, pada
proses penyepuhan perak pada perabot rumah tangga, kation perak
direduksi menjadi logam perak dengan cara memperoleh elektron. Reaksi
yang terjadi adalah sebagai berikut :
Seperti halnya oksidasi, ada tiga definisi yang dapat digunakan untuk menjelaskan reduksi, yaitu memperoleh elektron, kehilangan oksigen, atau memperoleh hidrogen. Reduksi
sering dilihat sebagai proses memperoleh elektron. Sebagai contoh, pada
proses penyepuhan perak pada perabot rumah tangga, kation perak
direduksi menjadi logam perak dengan cara memperoleh elektron. Reaksi
yang terjadi adalah sebagai berikut :
Ag+ + e- ——> Ag
Ketika mendapatkan elektron, para kimiawan mengatakan bahwa kation perak telah tereduksi menjadi logam perak.
Baik oksidasi maupun reduksi tidak
dapat terjadi sendiri, harus keduanya. Ketika elektron tersebut hilang,
sesuatu harus mendapatkannya. Sebagai contoh, reaksi yang terjadi antara
logam seng dengan larutan tembaga (II) sulfat dapat dinyatakan dalam
persamaan reaksi berikut :
Zn(s) + CuSO4(aq) ——> ZnSO4(aq) + Cu(s)
Zn(s) + Cu2+(aq) ——> Zn2+(aq) + Cu(s) (persamaan ion bersih)
Sebenarnya, reaksi keseluruhannya terdiri atas dua reaksi paruh :
Zn(s) ——> Zn2+(aq) + 2e-
Cu2+(aq) + 2e- ——> Cu(s)
Logam seng kehilangan dua elektron, sedangkan kation tembaga (II) mendapatkan dua elektron yang sama. Logam seng teroksidasi. Tetapi, tanpa adanya kation tembaga (II), tidak akan terjadi suatu apa pun. Kation tembaga (II) disebut zat pengoksidasi (oksidator). Oksidator menerima elektron yang berasal dari spesies kimia yang telah teroksidasi.
Sementara kation tembaga (II) tereduksi karena mendapatkan elektron. Spesies yang memberikan elektron disebut zat pereduksi (reduktor). Dalam hal ini, reduktornya adalah logam seng. Dengan demikian, oksidator adalah spesies yang tereduksi dan reduktor adalah spesies yang teroksidasi. Baik oksidator maupun reduktor berada di ruas kiri (reaktan) persamaan redoks.
 Elektrokimia adalah
salah satu dari cabang ilmu kimia yang mengkaji tentang perubahan
bentuk energi listrik menjadi energi kimia dan sebaliknya. Proses elektrokimia melibatkan reaksi redoks. Proses transfer elektron akan menghasilkan sejumlah energi listrik. Aplikasi elektrokimia dapat diterapkan dalam dua jenis sel, yaitu sel volta dan sel elektrolisis. Sebelum membahas kedua jenis sel tersebut, kita terlebih dahulu akan mempelajari metode penyetaraan reaksi redoks.
Elektrokimia adalah
salah satu dari cabang ilmu kimia yang mengkaji tentang perubahan
bentuk energi listrik menjadi energi kimia dan sebaliknya. Proses elektrokimia melibatkan reaksi redoks. Proses transfer elektron akan menghasilkan sejumlah energi listrik. Aplikasi elektrokimia dapat diterapkan dalam dua jenis sel, yaitu sel volta dan sel elektrolisis. Sebelum membahas kedua jenis sel tersebut, kita terlebih dahulu akan mempelajari metode penyetaraan reaksi redoks.
Persamaan reaksi redoks biasanya sangat kompleks, sehingga metode
penyeteraan reaksi kimia biasa tidak dapat diterapkan dengan baik.
Dengan demikian, para kimiawan mengembangkan dua metode untuk
menyetarakan persamaan redoks. Salah satu metode disebut metode perubahan bilangan oksidasi (PBO), yang berdasarkan pada perubahan bilangan oksidasi yang terjadi selama reaksi. Metode lain, disebut metode setengah reaksi (metode ion-elektron). Metode ini melibatkan dua buah reaksi paruh, yang kemudian digabungkan menjadi reaksi redoks keseluruhan.
Berikut ini penjelasan sekilas tentang metode setengah reaksi : persamaan
redoks yang belum setara diubah menjadi persamaan ion dan kemudian
dipecah menjadi dua reaksi paruh, yaitu reaksi oksidasi dan reaksi
reduksi; setiap reaksi paruh ini disetarakan dengan terpisah dan
kemudian digabungkan untuk menghasilkan ion yang telah disetarakan;
akhirnya, ion-ion pengamat kembali dimasukkan ke persamaan ion yang
telah disetarakan, mengubah reaksi menjadi bentuk molekulnya.
Sebagai contoh, saya akan menjelaskan langkah-langkah untuk menyetarakan persamaan redoks berikut :
Fe2+(aq) + Cr2O72-(aq) ——> Fe3+(aq) + Cr3+(aq)
1. Menuliskan persamaan reaksi keseluruhan
Fe2++ Cr2O72- ——> Fe3++ Cr3+
2. Membagi reaksi menjadi dua reaksi paruh
Fe2+ ——> Fe3+
Cr2O72- ——> Cr3+
3. Menyetarakan jenis atom dan jumlah atom dan muatan pada masing-masing setengah reaksi; dalam suasana asam, tambahkan H2O untuk menyetarakan atom O dan H+ untuk menyetarakan atom H
Fe2+ ——> Fe3++ e-
6 e- + 14 H+ + Cr2O72- ——> 2 Cr3+ + 7 H2O
4. Menjumlahkan kedua setengah reaksi; elektron pada kedua sisi harus saling meniadakan; jika oksidasi dan reduksi memiliki jumlah elektron yang berbeda, maka harus disamakan terlebih dahulu
6 Fe2+ ——> 6 Fe3+ + 6 e- ……………… (1)
6 e- + 14 H+ + Cr2O72- ——> 2 Cr3+ + 7 H2O ……………… (2)
6 Fe2+ + 14 H+ + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 7 H2O ………………… [(1) + (2)]
5. Mengecek kembali dan yakin bahwa kedua ruas memiliki jenis atom
dan jumlah atom yang sama, serta memiliki muatan yang sama pada kedua
ruas persamaan reaksi
Untuk reaksi yang berlangsung dalam suasana basa, tambahkan ion OH- dalam jumlah yang sama dengan ion H+ pada masing-masing ruas untuk menghilangkan ion H+. Persamaan reaksi tersebut berubah menjadi sebagai berikut :
6 Fe2+ + 14 H+ + 14 OH- + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 7 H2O + 14 OH-
6 Fe2+ + 14 H2O + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 7 H2O + 14 OH-
6 Fe2+ + 7 H2O + Cr2O72- ——> 6 Fe3+ + 2 Cr3+ + 14 OH-
Berikut ini adalah contoh lain penyelesaian penyetaraan persamaan reaksi redoks :
Cu(s) + HNO3(aq) ——> Cu(NO3)2(aq) + NO(g) + H2O(l)
1. Mengubah reaksi redoks yang belum disetarakan menjadi bentuk ion
Cu+ H+ + NO3- ——> Cu2+ + 2 NO3- + NO + H2O
2. Menentukan bilangan oksidasi dan menuliskan dua setengah reaksi (oksidasi dan reduksi) yang menunjukkan spesies kimia yang telah mengalami perubahan bilangan oksidasi
Cu ——> Cu2+
NO3- ——> NO
3. Menyetarakan semua atom, dengan pengecualian untuk oksigen dan hidrogen
Cu ——> Cu2+
NO3- ——> NO
4. Menyetarakan atom oksigen dengan menambahkan H2O pada ruas yang kekurangan oksigen
Cu ——> Cu2+
NO3- ——> NO + 2 H2O
5. Menyetarakan atom hidrogen dengan menambahkan H+ pada ruas yang kekurangan hidrogen
Cu ——> Cu2+
4 H+ + NO3- ——> NO + 2 H2O
6. Menyetarakan muatan ion pada setiap ruas setengah reaksi dengan menambahkan elektron
Cu ——> Cu2+ + 2 e-
3 e- + 4 H+ + NO3- ——> NO + 2 H2O
7. Menyetarakan kehilangan elektron dengan perolehan elektron antara kedua setengah reaksi
3 Cu ——> 3 Cu2+ + 6 e-
6 e- + 8 H+ + 2 NO3- ——> 2 NO + 4 H2O
8. Menggabungkan kedua reaksi paruh tersebut dan menghilangkan spesi yang sama di kedua sisi; elektron selalu harus dihilangkan (jumlah elektron di kedua sisi harus sama)
3 Cu ——> 3 Cu2+ + 6 e- …………………….. (1)
6 e- + 8 H+ + 2 NO3 ——> 2 NO + 4 H2O …………………….. (2)
3 Cu + 8 H+ + 2 NO3- ——> 3 Cu2+ + 2 NO + 4 H2O …………………………….. [(1) + (2)]
9. Mengubah persamaan reaksi kembali ke bentuk molekulnya dengan menambahkan ion pengamat
3 Cu + 8 H+ + 2 NO3- + 6 NO3- ——> 3 Cu2+ + 2 NO + 4 H2O + 6 NO3-
3 Cu+ 8 HNO3 ——> 3 Cu(NO3)2 + 2 NO + 4 H2O
10. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah
setara, semua muatannya telah setara, dan semua koefisiennya ada dalam
bentuk bilangan bulat terkecil
Metode lain yang digunakan dalam menyetarakan persamaan reaksi redoks adalah metode perubahan bilangan oksidasi (PBO). Saya akan menjelaskan langkah-langkah penyetaraan reaksi redoks dengan metode PBO melalu contoh berikut :
MnO4-(aq) + C2O42-(aq) ——> Mn2+(aq) + CO2(g)
1. Menentukan bilangan oksidasi masing-masing unsur
MnO4- + C2O42- ——> Mn2++ CO2
+7 -2 +3 -2 +2 +4 -2
2. Menentukan unsur yang mengalami perubahan bilangan oksidasi serta besarnya perubahan bilangan oksidasi
Mn mengalami perubahan bilangan oksidasi dari +7 menjadi +2; besarnya perubahan bilangan oksidasi (Δ) sebesar 5
C mengalami perubahan bilangan oksidasi dari +3 menjadi +4; besarnya perubahan bilangan okisdasi (Δ) sebesar 1
3. Mengalikan perubahan bilangan oksidasi (Δ) dengan jumlah atom yang mengalami perubahan bilangan oksidasi
Mn : Δ = 5 x 1 = 5
C : Δ = 1 x 2 = 2
4. Menyamakan jumlah atom yang mengalami perubahan bilangan oksidasi pada masing-masing ruas
MnO4- + C2O42- ——> Mn2++ 2 CO2
5. Menyamakan perubahan bilangan oksidasi (Δ); bilangan pengali dijadikan sebagai koefisien reaksi baru
Mn dikalikan 2 dan C dikalikan 5, sehingga Δ kedua unsur sama, yaitu sebesar 10
2 MnO4- + 5 C2O42-——> 2Mn2++ 10 CO2
6. Dalam tahap ini, reaksi hampir selesai disetarakan; selanjutnya atom O dapat disetarakan dengan menambahkan H2O pada ruas yang kekurangan atom O; sementara untuk menyetarakan atom H, gunakan H+
16 H+ + 2 MnO4- + 5 C2O42-——> 2Mn2++ 10 CO2 + 8 H2O
7. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah
setara, semua muatannya telah setara, dan semua koefisiennya ada dalam
bentuk bilangan bulat terkecil
Untuk reaksi yang berlangsung dalam suasana basa, tambahkan ion OH- dalam jumlah yang sama dengan ion H+ pada masing-masing ruas untuk menghilangkan ion H+. Persamaan reaksi tersebut berubah menjadi sebagai berikut :
16 OH- + 16 H+ + 2 MnO4- + 5 C2O42-——> 2Mn2++ 10 CO2 + 8 H2O + 16 OH-
16 H2O + 2 MnO4- + 5 C2O42-——> 2Mn2++ 10 CO2 + 8 H2O + 16 OH-
8 H2O + 2 MnO4- + 5 C2O42-——> 2Mn2++ 10 CO2 + 16 OH-
Selanjutnya, saya akan kembali memberikan sebuah contoh penyelesaian persamaan reaksi redoks dengan metode PBO :
MnO(s) + PbO2(s) + HNO3(aq) ——> HMnO4(aq) + Pb(NO3)2(aq) + H2O(l)
1. Mengubah reaksi redoks yang belum disetarakan menjadi bentuk ion
MnO + PbO2 + H+ + NO3‑ ——> H+ + MnO4- + Pb2+ + 2 NO3- + H2O
2. Menentukan bilangan oksidasi masing-masing unsur
MnO + PbO2 + H+ + NO3‑ ——> H+ + MnO4- + Pb2++ 2 NO3- + H2O
+2 -2 +4 -2 + 1 +5 -2 +1 +7 -2 +2 +5 -2 +1 -2
3. Menuliskan kembali semua unsur yang mengalami perubahan bilangan oksidasi; ion pengamat tidak disertakan
MnO + PbO2 ——> MnO4- + Pb2+
+2 -2 +4 -2 +7 -2 +2
4. Menentukan unsur yang mengalami perubahan bilangan oksidasi serta besarnya perubahan bilangan oksidasi
Mn mengalami perubahan bilangan oksidasi dari +2 menjadi +7; besarnya perubahan bilangan oksidasi (Δ) sebesar 5
Pb mengalami perubahan bilangan oksidasi dari +4 menjadi +2; besarnya perubahan bilangan okisdasi (Δ) sebesar 2
5. Mengalikan perubahan bilangan oksidasi (Δ) dengan jumlah atom yang mengalami perubahan bilangan oksidasi
Mn : Δ = 5 x 1 = 5
Pb : Δ = 2 x 1 = 2
6. Menyamakan jumlah atom yang mengalami perubahan bilangan oksidasi pada masing-masing ruas
MnO + PbO2 ——> MnO4- + Pb2+
7. Menyamakan perubahan bilangan oksidasi (Δ); bilangan pengali dijadikan sebagai koefisien reaksi baru
Mn dikalikan 2 dan Pb dikalikan 5, sehingga Δ kedua unsur sama, yaitu sebesar 10
2 MnO + 5 PbO2 ——> 2 MnO4- + 5 Pb2+
8. Dalam tahap ini, reaksi hampir selesai disetarakan; selanjutnya atom O dapat disetarakan dengan menambahkan H2O pada ruas yang kekurangan atom O; sementara untuk menyetarakan atom H, gunakan H+
8 H+ + 2 MnO + 5 PbO2 ——> 2 MnO4- + 5 Pb2+ + 4 H2O
9. Mengubah persamaan reaksi kembali ke be ntuk molekulnya dengan menambahkan ion pengamat
10 NO3- + 2 H+ + 8 H+ + 2 MnO + 5 PbO2 ——> 2 MnO4- + 5 Pb2+ + 4 H2O + 2 H+ + 10 NO3-
2 MnO + 5 PbO2 + 10 HNO3 ——> 2 HMnO4 + 5 Pb(NO3)2 + 4 H2O
10. Memeriksa kembali untuk meyakinkan bahwa semua atomnya telah
setara, semua muatannya telah setara, dan semua koefisiennya ada dalam
bentuk bilangan bulat terkecil
Pada pembahasan sebelumnya, kita telah mengetahui bahwa saat sepotong
logam seng dicelupkan ke dalam larutan tembaga (II) sulfat, akan
terjadi reaksi redoks. Logam seng akan teroksidasi menjadi ion Zn2+, sementara ion Cu2+ akan tereduksi menjadi logam tembaga yang menutupi permukaan logam seng. Persamaan untuk reaksi ini adalah sebagai berikut :
Zn(s) + Cu2+(aq) ——> Zn2+(aq) + Cu(s)
Ini merupakan contoh perpindahan elektron langsung. Logam seng memberikan dua elektron (menjadi teroksidasi) ke ion Cu2+ yang menerima kedua elektron tersebut (mereduksinya menjadi logam tembaga). Logam tembaga akan melapisi permukaan logam seng.
Seandainya kedua reaksi paruh tersebut dapat dipisahkan, sehingga ketika logam seng teroksidasi, ele ktron akan dilepaskan dan dialirkan melalui kawat penghantar untuk mencapai ion Cu2+ (perpindahan elektron tidak langsung),
kita akan mendapatkan sesuatu yang bermanfaat. Selama reaksi kimia
berlangsung, akan terjadi aliran elektron yang menghasilkan energi
listrik. Peralatan yang dapat mengubah energi kimia (reaksi redoks) menjadi arus listrik (aliran elektron = energi listrik) dikenal dengan Sel Volta atau Sel Galvani.
ktron akan dilepaskan dan dialirkan melalui kawat penghantar untuk mencapai ion Cu2+ (perpindahan elektron tidak langsung),
kita akan mendapatkan sesuatu yang bermanfaat. Selama reaksi kimia
berlangsung, akan terjadi aliran elektron yang menghasilkan energi
listrik. Peralatan yang dapat mengubah energi kimia (reaksi redoks) menjadi arus listrik (aliran elektron = energi listrik) dikenal dengan Sel Volta atau Sel Galvani.
Salah satu contoh sel volta yang sering digunakan para kimiawan adalah Sel Daniell. Sel volta ini menggunakan reaksi antara logam Zn dan ion Cu2+ untuk menghasilkan listrik. Sel Daniell diberi nama menurut penemunya, John Frederic Daniell, seorang kimiawan Inggris yang menemukannya pada tahun 1836).
Pada Sel Daniell, sepotong logam seng dimasukkan ke dalam larutan seng (II) sulfat, ZnSO4(aq), pada satu wadah. Sementara, sepotong logam tembaga juga dimasukkan ke dalam larutan tembaga (II) sulfat, CuSO4(aq), pada wadah lainnya. Potongan logam tersebut disebut elektroda
yang berfungsi sebagai ujung akhir atau penampung elektron. Kawat
penghantar akan menghubungkan elektroda-elektrodanya. Selanjutnya,
rangkaian sel dilengkapi pula dengan jembatan garam. Jembatan garam,
biasanya berupa tabung berbentuk U yang terisi penuh dengan larutan
garam pekat, memberikan jalan bagi ion untuk bergerak dari satu tempat
ke tempat lainnya untuk menjaga larutan agar muatan listriknya tetap
netral.

Sel Daniell bekerja atas dasar prinsip reaksi redoks. Logam seng teroksidasi
dan membebaskan elektron yang mengalir melalui kawat menuju elektroda
tembaga. Selanjutnya, elektron tersebut digunakan oleh ion Cu2+ yang mengalami reduksi membentuk logam tembaga. Ion Cu2+ dari
larutan tembaga (II) sulfat akan melapisi elektroda tembaga, sedangkan
elektroda seng semakin berkurang (habis). Kation-kation di dalam jembatan garam berpindah
ke wadah yang mengandung elektroda tembaga untuk menggantikan ion
tembaga yang semakin habis. Sebaliknya, anion-anion pada jembatan garam berpindah ke sisi elektroda seng, yang menjaga agar larutan yang mengandung ion Zn2+ tetap bermuatan listrik netral.
Elektroda seng disebut anoda, yaitu elektroda yang menjadi tempat terjadinya reaksi oksidasi. Oleh karena anoda melepaskan elektron, maka anoda kaya akan elektron sehingga diberi tanda negatif (kutub negatif). Sementara, elektroda tembaga disebut katoda, yaitu elektroda yang menjadi tempat terjadinya reaksi reduksi. Oleh karena katoda menerima elektron, maka katoda kekurangan elektron sehingga diberi tanda positif (kutub positif).
Reaksi yang terjadi pada masing-masing elektroda (reaksi setengah sel) adalah sebagai berikut :
Anoda (-) : Zn(s) ——> Zn2+(aq) + 2e- ……………………. (1)
Katoda (+) : Cu2+(aq) + 2e- ——> Cu(s)……………………. (2)
Reaksi Sel : Zn(s) + Cu2+(aq) ——> Zn2+(aq) + Cu(s) …………………………… [(1) + (2)]
Munculnya arus listrik (aliran elektron) yang terjadi dari anoda menuju katoda disebabkan oleh perbedaan potensial elektrik antara kedua elektroda tersebut. Melalui percobaan, perbedaan potensial elektrik antara katoda dan anoda dapat diukur dengan voltmeter dan hasilnya berupa potensial standar sel (E°sel). Semakin besar perbedaan potensial elektrik, semakin besar pula arus listrik dan potensial standar sel yang dihasilkan.
Reaksi yang terjadi pada sel volta dapat dinyatakan dalam bentuk yang lebih ringkas, yaitu notasi sel. Sesuai dengan kesepakatan, reaksi oksidasi dinyatakan di sisi kiri, sementara reaksi reduksi dinyatakan di sisi kanan. Notasi sel untuk Sel Daniell adalah sebagai berikut :
Zn(s) / Zn2+(aq) // Cu2+(aq) / Cu(s)
Saat konsentrasi ion Cu2+ dan Zn2+ masing-masing 1 M, terlihat pada voltmeter bahwa besarnya potensial standar sel (E°sel) bagi Sel Daniell adalah 1,10 V pada suhu 25°C. Oleh karena reaksi sel merupakan hasil penjumlahan dari dua reaksi setengah sel, maka potensial standar sel merupakan hasil penjumlahan dari dua potensial standar setengah sel. Pada Sel Daniell, potensial standar sel merupakan hasil penjumlahan potensial elektroda Cu dan Zn. Dengan mengetahui potensial standar dari masing-masing elektroda, kita dapat menentukan besarnya potensial standar sel lain yang terbentuk. Potensial yang digunakan dalam pemahasan ini adalah potensial standar reduksi.

Potensial standar reduksi masing-masing elektroda dapat ditentukan dengan membandingkannya terhadap elektroda standar (acuan), yaitu elektroda hidrogen standar (SHE = Standard Hydrogen Electrode). Keadaan standar yang dimaksud adalah saat tekanan gas H2 sebesar 1 atm, konsentrasi larutan ion H+ sebesar 1 M, dan dan pengukuran dilakukan pada suhu 25°C. Sesuai dengan kesepakatan, SHE memiliki potensial standar reduksi sebesar nol (E°red SHE = 0).
2 H+(1 M) + 2 e- ——> H2 (1 atm) E°red = 0 V
SHE dapat digunakan untuk menentukan besarnya potensial standar reduksi (E°red) elektroda lainnya. Dengan demikian, kita dapat menyusun suatu daftar yang berisi urutan nilai E°red elektroda-elektroda,
dari yang terkecil (paling negatif) hingga yang terbesar (paling
positif). Susunan elektroda-elektroda tersebut di kenal dengan istilah Deret Volta (deret kereaktifan logam).
HIDROKARBON

beberapa bidang utama. Terdapat pula beberapa cabang antar-bidang dan cabang-cabang yang lebih khusus dalam kimia.
1. Kimia analitik adalah analisis cuplikan bahan untuk memperoleh
pemahaman tentang susunan kimia dan strukturnya. Kimia analitik
melibatkan metode eksperimen standar dalam kimia. Metode-metode ini
dapat digunakan dalam semua subdisiplin lain dari kimia, kecuali untuk
kimia teori murni.
2. Biokimia mempelajari senyawa kimia, reaksi kimia, dan interaksi kimia
yang terjadi dalam organisme hidup. Biokimia dan kimia organik
berhubungan sangat erat, seperti dalam kimia medisinal atau neurokimia.
Biokimia juga berhubungan dengan biologi molekular, fisiologi, dan
genetika.
3. Kimia anorganik mengkaji sifat-sifat dan reaksi senyawa anorganik.
Perbedaan antara bidang organik dan anorganik tidaklah mutlak dan banyak
terdapat tumpang tindih, khususnya dalam bidang kimia organologam.
4. Kimia organik mengkaji struktur, sifat, komposisi, mekanisme, dan
reaksi senyawa organik. Suatu senyawa organik didefinisikan sebagai
segala senyawa yang berdasarkan rantai karbon.
5. Kimia fisik mengkaji dasar fisik sistem dan proses kimia, khususnya
energitika dan dinamika sistem dan proses tersebut. Bidang-bidang
penting dalam kajian ini di antaranya termodinamika kimia, kinetika
kimia, elektrokimia, mekanika statistika, dan spektroskopi. Kimia fisik
memiliki banyak tumpang tindih dengan fisika molekular. Kimia fisik
melibatkan penggunaan kalkulus untuk menurunkan persamaan, dan biasanya
berhubungan dengan kimia kuantum serta kimia teori.
6. Kimia teori (kimia dasar) adalah studi kimia melalui penjabaran teori
dasar (biasanya dalam matematika atau fisika). Secara spesifik,
penerapan mekanika kuantum dalam kimia disebut kimia kuantum. Sejak
akhir Perang Dunia II, perkembangan komputer telah memfasilitasi
pengembangan sistematik kimia komputasi, yang merupakan seni
pengembangan dan penerapan program komputer untuk menyelesaikan
permasalahan kimia. Kimia teori memiliki banyak tumpang tindih (secara
teori dan eksperimen) dengan fisika benda kondensi dan fisika molekular.
7. Kimia nuklir mengkaji bagaimana partikel subatom bergabung dan
membentuk inti. Transmutasi modern adalah bagian terbesar dari kimia
nuklir dan tabel nuklida merupakan hasil sekaligus perangkat untuk
bidang ini.
Bidang lain antara lain adalah astrokimia, biologi molekular,
elektrokimia, farmakologi, fitokimia, fotokimia, genetika molekular,
geokimia, ilmu bahan, kimia aliran, kimia atmosfer, kimia benda padat,
kimia hijau, kimia inti, kimia medisinal, kimia komputasi, kimia
lingkungan, kimia organologam, kimia permukaan, kimia polimer, kimia
supramolekular, nanoteknologi, petrokimia, sejarah kimia, sonokimia,
teknik kimia, serta termokimia.
KIMIA ANALITIK

Gugus fungsional
Gugus fungsional (istilah dalam kimia organik) adalah kelompok gugus
khusus pada atom dalam molekul, yang berperan dalam memberi
karakteristik reaksi kimia pada molekul tersebut. Senyawa yang bergugus
fungsional sama memiliki reaksi kimia yang sama atau mirip.
Berikut adalah daftar gugus fungsional yang sering dijumpai. Di dalam
penulisan rumus, simbol R dan R’ selalu menyatakan ikatan hidrogen atau
rantai hidrokarbon, atau suatu gugus atom.
Kelas kimiawi Gugus Rumus Rumus struktural Awalan Akhiran Contoh
Asil halida
Haloformil RCOX haloformil- -oil halida
Asetil klorida
(Etanoil klorida)
Alkohol
Hidroksil
ROH hidroksi- -ol
Metanol
Aldehida
Aldehida
RCHO okso- -al
Asetaldehida
(Etanal)
Alkana
Alkil
RH alkil- -ana
Metana
KIMIA ANALITIK
Kimia analitik adalah cabang ilmu kimia yang berfokus pada analisis
cuplikan material untuk mengetahui komposisi, struktur, dan fungsi
kimiawinya. Secara tradisional, kimia analitik dibagi menjadi dua jenis,
kualitatif dan kuantitatif. Analisis kualitatif bertujuan untuk
mengetahui keberadaan suatu unsur atau senyawa kimia, baik organik
maupun inorganik, sedangkan analisis kuantitatif bertujuan untuk
mengetahui jumlah suatu unsur atau senyawa dalam suatu cuplikan.
Kimia analitik modern dikategorisasikan melalui dua pendekatan,
target dan metode. Berdasarkan targetnya, kimia analitik dapat dibagi
menjadi kimia bioanalitik, analisis material, analisis kimia, analisis
lingkungan, dan forensik. Berdasarkan metodenya, kimia analitik dapat
dibagi menjadi spektroskopi, spektrometri massa, kromatografi dan
elektroforesis, kristalografi, mikroskopi, dan elektrokimia.
Meskipun kimia analitik modern didominasi oleh instrumen-instrumen
canggih, akar dari kimia analitik dan beberapa prinsip yang digunakan
dalam kimia analitik modern berasal dari teknik analisis tradisional
yang masih dipakai hingga sekarang. Contohnya adalah titrasi dan
gravimetri.
SEMESTER 3
KIMIA ANALITIK
Istilah stoikiometri berasal dari bahasa Yunani yaitu stoicheon yang
berarti unsur dan metron yang berarti pengukuran. Jadi, stoikiometri
adalah ilmu yang mempelajari hubungan kuantitatif antara pereaksi dan
produk dalam reaksi. Stoikiometri dapat dikatakan pula sebagai hitungan
kimia.
Untuk dapat memahami konsep stoikiometri larutan, maka harus memahami
terlebih dahulu jenis-jenis reaksi dalam larutan elektrolit, pengertian
konsentrasi, konsep mol, dan persamaan reaksi.
A. Reaksi dalam Larutan Elektrolit
Apakah kamu masih ingat tentang larutan yang dapat menghantarkan arus
listrik? Disebut larutan apakah larutan tersebut? Reaksi yang
berlangsung dalam larutan tersebut adalah reaksi ionisasi. Larutan
tersebut adalah larutan elektrolit. Larutan elektrolit digolongkan
menjadi dua macam yaitu larutan elektrolit lemah dan larutan elektrolit
kuat.
Reaksi antara ion-ion dalam larutan elektrolit dapat menghasilkan senyawa kovalen, endapan, gas, atau perubahan warna larutan.
1. Reaksi Penetralan Asam Basa
Reaksi antara senyawa asam dan basa dapat menghasilkan garam mineral dan air
Asam + basa ↔ garam + H2O
Contoh:
KOH(aq) + HCl(aq) KCl(aq) + H2O(1)
Mg(OH)2(aq) + H2SO4(aq) MgSO4 + 2 H2O(1)
Reaksi antara asam dan basa umumnya disebut dengan reaksi penetralan.
Akan tetapi, tidak semua garam yang dihasilkan dari reaksi ini bersifat
netral. Ada garam-garam yang mempunyai sifat asam atau basa. Hal ini
tergantung dari kuat atau lemahnya asam dan basa yang bereaksi
membentuknya.
asam kuat + basa → kuat garam netral
asam kuat + basa → lemah garam bersifat asam
asam lemah + basa kuat → garam bersifat basa
Konsentrasi larutan asam atau basa dapat ditentukan berdasarkan reaksi
yang terjadi dalam larutan tersebut. Cara ini dikenal sebagai titrasi
asam basa. Eksperimen titrasi dilakukan dengan menambahkan larutan asam
atau basa yang diketahui konsentrasinya (larutan standar) ke dalam
larutan asam atau basa yang ingin diketahui konsentrasinya. Penambahan
terus dilakukan sampai tercapai titik ekuivalen, yaitu titik saat asam
dan basa tepat habis bereaksi. Jika volume larutan standar dan larutan
sampel diketahui, maka konsentrasi larutan sampel dapat ditentukan.
2. Reaksi Oksida Basa dengan Asam
Oksida basa beraksi dengan asam membentuk garam dan air
Oksida basa + asam → garam + H2O
Contoh:
K2O(s) + H2SO4(aq) → K2SO4(aq) + H2O(1)
3. Reaksi Oksida Asam dengan Basa
Reaksi antara oksida asama dengan basa dapat membentuk garam dan air
Oksida asam + basa → garam + H2O
Contoh
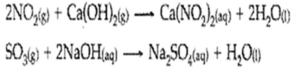
4. Reaksi Pengendapan
Beberapa kation dan anion dalam larutan elektrolit dapat membentuk larutan yang sukar larut dalam air
Contoh:
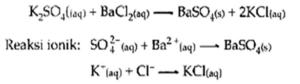
5. Reaksi yang Menghasilkan Gas
Reaksi larutan asam dengan abebrapa logam menghasilkan gas hidrogen.
Oksida asam + logam → garam + H2
Contoh:

Logam yang dapat bereaksi dengan asam adalah logam yang terletak di sebelah kiri atom hidrogen pada deret volta berikut:

B. Stokiometri Larutan
Sebagian besar reaksi kimia dapat berlangsung lebih cepat apabila
pereaksi dalam bentuk larutan. Mengapa demikian? Apa yang membedakan
reaksi kimia dalam larutan (campuran homogen) dengan campuran heterogen?
Sebelum pembahasan tentang stoikiometri larutan maka kita akan bahas
terlebih dahulu tentang konsentrasi larutan.
1. Konsentrasi Larutan
a. Pengertian Konsentrasi Larutan
Konsentrasi adalah istilah umum untuk menyatakan banyaknya bagian zat
terlarut dan pelarut yang terdapat dalam larutan. Konsentrasi dapat
dinyatakan secara kuantitatif maupun secara kualitatif. Untuk ukuran
secara kualitatif, konsentrasi larutan dinyatakan dengan istilah larutan
pekat (concentrated) dan encer (dilute). Kedua isitilah ini menyatakan
bagian relatif zat terlarut dan pelarut dalam larutan. Larutan pekat
berarti jumlah zat terlarut relatif besar, sedangkan larutan encer
berarti jumlah zat terlarut relatif lebih sedikit. Biasanya, istilah
pekat dan encer digunakan untuk membandingkan konsentrasi dua atau lebih
larutan.
Dalam ukuran kuantitatif, konsentrasi larutan dinyatakan dalam g/mL
(sama seperti satuan untuk densitas). Namun, dalam perhitungan
stoikiometri satuan gram diganti dengan satuan mol sehingga diperoleh
satuan mol/L. Konsentrasi dalam mol/L atau mmol/mL dikenal dengan
istilah molaritas atau konsentrasi molar.
b. Molaritas
Molaritas atau kernolaran menyatakan jumlah mol zat terlarut (n) dalam
satu liter larutan (L) atau milimol zat terlarut (n) dalam setiap satu
mililiter larutan (mL).
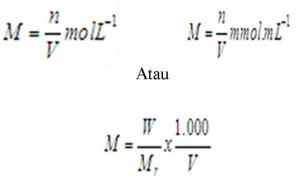
Keterangan: W = berat zat (gram)
Mr = masa molekul relative zat
V = volume larutan (mL)
Suatu larutan dapat dibuat dengan cara melarutkan zat terlarut
murniatau mengencerkan dari larutan pekatnya: Agar lebih jelas,
perhatikanlah contoh berikut:
1) Penentuan Molaritas dengan Cara Pelarutan
Jika kita ingin membuat 250 mL larutan K2CrO4 0,25 M dari bentuk
kristal, caranya adalah dengan menghitung massa zat yang akan
dilarutkan.
mol K2CrO4 = 250 mL x 0,25 M
= 0,0625 mol
g K2CrO4 = 0,0625 mol x 194 g / mol
= 12,125 g
Jadi, yang harus dilakukan adalah melarutkan 12,125 g kristal K2CrO4 ke dalam 250 mL air
2) Penentuan Molaritas dengan Cara Pengenceran
Jika larutan di atas akan diubah konsentrasinya menjadi 0,01 M K2CrO4,
caranya adalah dengan cara pengenceran. Dalam pengenceran kita akan
mengubah volume dan kemolaran larutan, namun tidak mengubah jumlah mol
zat terlarut.
nl =n2 → n = MV
↓
M1 V1 =M2V2
Keterangan:
M1 = konsentrasi sebelum pengenceran
V1 = volume sebelum pengenceran
M2 = konsentrasi setelah pengenceran
V2 = volume setelah pengenceran
Untuk contoh di atas, kita dapat mengambil 10 mL larutan K2CrO4 0,25M. Setelah itu, dilakukan pengenceran dengan perhitungan:
M1V1 = M2V2
0,25M x 10mL = 0,01MxV2
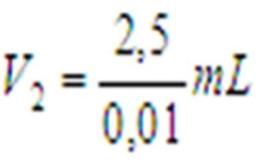
= 250 mL
Jadi, yang harus dilakukan adalah mengencerkan 10 mL K2CrO4 0,25 M sampai volumenya menjadi 250 mL.
Jika dua jenis larutan dicampurkan dan jumlah mol zat terlarut mengalami
perubahan (n1 tidak sama dengan n2), maka mol zat setelah dicampurkan
tergantung kepada jumlah
nl dan n2 sedangkan volume larutannya menjadi V1 + V2.

Di laboratorium, larutan-larutan pekat tidak diketahui molaritasnya,
tetapi yang diketahui (dapat dibaca pada etiket botol) adalah kadar
(dalam satuan persen berat) dan densitas (g / mL). Bagaimanakah membuat
larutan dengan molaritas tertentu dari larutan pekat? Prinsipnya sama
dengan cara pengenceran. Sebagai contoh, pembuatan 100 mL larutan asam
perklorat 0,1 M dari asam perklorat dengan etiket: kadar 70% dan
densitas 1,664 g/mL. Caranya adalah dengan mencari molaritas larutan
pekat terlebih dahulu. Untuk memperoleh nilai M, maka kita harus
mengubah kadar (%) menjadi mol dan mengkonversi massa (gram) menjadi
volume (mL).

= 11,59 M HClO4
Dari contoh di atas dapat diturunkan rumus:
Molaritas (M) = Persen berat x Densitas x 10 / Mr
Setelah molaritas diketahui, kemudian yang harus diambil (V1). Dalam hal ini, volume HC1O4 yang akan diambil adalah
V1 M1 = V2 M2
V1 x 11,59 M = 100 mL x 0,1
M V1 = 0,863 mL
Sebanyak 0,863 mL HC1O4 11,59 M dimasukkan ke labu takar berukuran
100 mL, kemudian ditambahkan akuades sampai tanda batas 100 mL dan
digojog sampai homogen. Sekarang diperoleh larutan HC1O4 0,1 M sebanyak
100 mL
2. Perhitungan Kimia
a. Mol dan Persamaan Reaksi
Di kelas X kamu telah mempelajari tentang konsep mol. Pada pokok bahasan
ini, kamu akan mempelajari konsep mol dan persamaan reaksi secara
terpadu. Kita telah memahami bahwa satu mol suatu senyawa mengandung
6,02 x 1023 partikel senyawa tersebut. Jika diterapkan untuk atom atau
molekul, maka:
1 mol = 6,02 x 1023 atom / molekul
Untuk mengingatkan hubungan antara konsep mol dengan jumlah partikel,
massa atom/ molekul, volume standar, dan molaritas, perhatikan diagram
“Jembatan Mol” berikut!
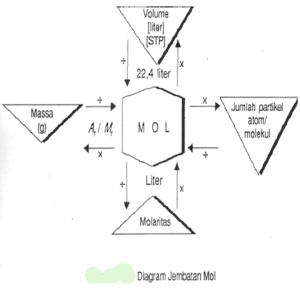
Bagan di atas memperlihatkan bahwa mol dapat men¬jembatani berbagai
parameter sehingga memudahkan kita untuk memahami sebuah reaksi kimia.
Pada bagan tersebut, ditunjukkan bahwa semua jalur yang menuju ke mol
menggunakan tanda “ pembagian “, sedangkan jalur yang keluar dari mol
menggunakan tanda “perkalian”, kecuali untuk molaritas (M).
Sebagai contoh, perhatikan reaksi berikut!
H2(g) + O2(g) — H2O(g)
Reaksi di atas memperlihatkan bahwa jumlah atom oksigen pada reaktan ada
dua buah, sedangkan jumlah oksigen di produk ada satu buah. Hal ini
berbeda dengan atom H yang sudah sama. Oleh karena itu, reaksi harus
disetarakan.
Penyetaraan reaksi dapat dilakukan dengan membuat koefisien O2 = ½ sehingga persamaan reaksinya menjadi sebagai berikut.
H2(g) + ½ O2(g) — H2O(g)
Pada reaksi di atas jumlah atom O dengan H pada reaktan sudah setara
dengan jumlah atom O dan H pada produk. Angka pecahan dalam persamaan
dapat dihilangkan dengan mengalikan dua terhadap semua koefisien reaksi.
2H2(g) + O2(g) 2H2O(g)
Persamaan reaksi di atas menunjukkan bahwa koefisien reaksi
masing-masing untuk H2, 02, dan H2O adalah 2, 1, dan 2. Dalam
perhitungan kimia, koefisien reaksi melambangkan perbandingan mol zat
reaktan dan produk dalam suatu reaksi. Artinya, perbandingan mol dalam
reaksi di atas, yaitu antara H2, 02, dan H2O adalah 2 : 1 : 2.
Perhatikanlah ilustrasi di bawah ini!
2H2(g) + O2(g) —————- 2H2O(g)
Perbandingan mol 2 : 1 : 2

Contoh lain adalah pembakaran gas metana di udara.
metana + oksigen ———————— karbondioksida + air
CH4 + 202 ———————– CO2 + 2H20
Persamaan reaksi menunjukkan bahwa 1 mol CH4 bereaksi dengan 2 mol O2 menghasilkan 1 mol CO2 dan 2 mol H2O.
Dari persamaan reaksi dapat kita katakan bahwa:
Jumlah mol H2O yang dihasilkan = 2
Jumlah mol CH4 yang beraksi 1
Perbandingan ini dapat digunakan untuk menghitung massa air yang
dihasilkan ketika sejumlah tertentu gas metana terbakar di udara.

Secara umum iklim merupakan hasil interaksi proses-proses fisik dan
kimiafisik dimana parameter-parameternya adalah seperti suhu,
kelembaban, angin, dan pola curah hujan yang terjadi pada suatu tempat
di muka bumi. Iklim merupakan suatu kondisi rata-rata dari cuaca, dan
untuk mengetahui kondisi iklim suatu tempat, diperlukan nilai rata-rata
parameterparameternya selama kurang lebih 10 sampai 30 tahun. Iklim
muncul setelah berlangsung suatu proses fisik dan dinamis yang kompleks
yang terjadi di atmosfer bumi. Kompleksitas proses fisik dan dinamis di
atmosfer bumi ini berawal dari perputaran planet bumi mengelilingi
matahari dan perputaran bumi pada porosnya. Pergerakan planet bumi ini
menyebabkan besarnya energi matahari yang diterima oleh bumi tidak
merata, sehingga secara alamiah ada usaha pemerataan energi yang
berbentuk suatu sistem peredaran udara, selain itu matahari dalam
memancarkan energi juga bervariasi atau berfluktuasi dari waktu ke
waktu. Perpaduan antara proses-proses tersebut dengan unsur-unsur iklim
dan faktor pengendali iklim menghantarkan kita pada kenyataan bahwa
kondisi cuaca dan iklim bervariasi dalam hal jumlah, intensitas dan
distribusinya.
Secara alamiah sinar matahari yang masuk ke bumi, sebagian akan
dipantulkan kembali oleh permukaan bumi ke angkasa. Sebagian sinar
matahari yang dipantulkan itu akan diserap oleh gas-gas di atmosfer yang
menyelimuti bumi –disebut gas rumah kaca, sehingga sinar tersebut
terperangkap dalam bumi. Peristiwa ini dikenal dengan efek rumah kaca
(ERK) karena peristiwanya sama dengan rumah kaca, dimana panas yang
masuk akan terperangkap di dalamnya, tidak dapat menembus ke luar kaca,
sehingga dapat menghangatkan seisi rumah kaca tersebut.
Efek Rumah Kaca
Peristiwa alam ini menyebabkan bumi menjadi hangat dan layak
ditempati manusia, karena jika tidak ada ERK maka suhu permukaan bumi
akan 33 derajat Celcius lebih dingin. Gas Rumah Kaca (GRK) seperti CO2 (Karbon dioksida),CH4(Metan) dan N2O (Nitrous Oksida), HFCs (Hydrofluorocarbons), PFCs (Perfluorocarbons) and SF6
(Sulphur hexafluoride) yang berada di atmosfer dihasilkan dari berbagai
kegiatan manusia terutama yang berhubungan dengan pembakaran bahan
bakar fosil (minyak, gas, dan batubara) seperti pada pembangkitan tenaga
listrik, kendaraan bermotor, AC, komputer, memasak. Selain itu GRK juga
dihasilkan dari pembakaran dan penggundulan hutan serta aktivitas
pertanian dan peternakan. GRK yang dihasilkan dari kegiatan tersebut,
seperti karbondioksida, metana, dan nitroksida, menyebabkan meningkatnya
konsentrasi GRK di atmosfer.
Berubahnya komposisi GRK di atmosfer, yaitu meningkatnya konsentrasi
GRK secara global akibat kegiatan manusia menyebabkan sinar matahari
yang dipantulkan kembali oleh permukaan bumi ke angkasa, sebagian besar
terperangkap di dalam bumi akibat terhambat oleh GRK tadi. Meningkatnya
jumlah emisi GRK di atmosfer pada akhirnya menyebabkan meningkatnya suhu
rata-rata permukaan bumi, yang kemudian dikenal dengan Pemanasan
Global.
Sinar matahari yang tidak terserap permukaan bumi akan dipantulkan
kembali dari permukaan bumi ke angkasa. Setelah dipantulkan kembali
berubah menjadi gelombang panjang yang berupa energi panas. Namun
sebagian dari energi panas tersebut tidak dapat menembus kembali atau
lolos keluar ke angkasa, karena lapisan gas-gas atmosfer sudah terganggu
komposisinya. Akibatnya energi panas yang seharusnya lepas keangkasa
(stratosfer) menjadi terpancar kembali ke permukaan bumi (troposfer)
atau adanya energi panas tambahan kembali lagi ke bumi dalam kurun waktu
yang cukup lama, sehingga lebih dari dari kondisi normal, inilah efek
rumah kaca berlebihan karena komposisi lapisan gas rumah kaca di
atmosfer terganggu, akibatnya memicu naiknya suhu rata-rata dipermukaan
bumi maka terjadilah pemanasan global. Karena suhu adalah salah satu
parameter dari iklim dengan begitu berpengaruh pada iklim bumi,
terjadilah perubahan iklim secara global.

Pemanasan global dan perubahan iklim menyebabkan terjadinya kenaikan
suhu, mencairnya es di kutub, meningkatnya permukaan laut, bergesernya
garis pantai, musim kemarau yang berkepanjangan, periode musim hujan
yang semakin singkat, namun semakin tinggi intensitasnya, dan
anomaly-anomali iklim seperti El Nino – La Nina dan Indian Ocean Dipole
(IOD). Hal-hal ini kemudian akan menyebabkan tenggelamnya beberapa pulau
dan berkurangnya luas daratan, pengungsian besar-besaran, gagal panen,
krisis pangan, banjir, wabah penyakit, dan lain-lainnya
HIDROKARBON
Ikatan dalam halogenalkana
Halogenalkana (juga dikenal sebagai haloalkana atau alkil halida)
adalah senyawa-senyawa yang mengandung sebuah atom halogen (fluor, klor,
bromin, atau iodin) yang terikat dengan satu atau lebih atom karbon
pada sebuah rantai.
Hal yang menarik tentang senyawa-senyawa ini adalah ikatan
karbon-halogen, dan semua reaksi substitusi nukleofilik halogenalkana
melibatkan pemutusan ikatan ini.
Polaritas ikatan karbon-halogen
Terkecuali iodin, semua halogen lebih elektronegatif dibanding atom karbon.
Nilai keelektronegatifan (Skala Pauling)
| C |
2.5 |
F |
4.0 |
|
|
Cl |
3.0 |
|
|
Br |
2.8 |
|
|
I |
2.5 |
Keelektronegatifan halogen (terkecuali iodin) yang lebih besar dari
keelektronegatifan atom karbon berarti bahwa pasangan elektron dalam
ikatan karbon-halogen akan tertarik ke ujung halogen, sehingga membuat
halogen sedikit bermuatan negatif ( -) dan atom karbon sedikit bermuatan positif (
-) dan atom karbon sedikit bermuatan positif ( +) – kecuali untuk ikatan karbon-iodin.
+) – kecuali untuk ikatan karbon-iodin.
Walaupun ikatan karbon-iodin tidak memiliki dipol permanen, ikatan ini
sangat mudah dipolarisasi oleh apapun yang mendekatinya. Coba anda
bayangkan sebuah ion negatif yang mendekati ikatan ini dari sisi yang
berjauhan dengan ujung atom karbon:
Polaritas ikatan karbon-bromin yang cukup kecil akan meningkat dengan efek yang sama seperti ditunjukkan pada gambar di atas.
Kekuatan ikatan karbon-halogen
Perhatikan kekuatan ikatan-ikatan berikut (semua nilai dalam kJ mol-1).
| C-H |
413 |
C-F |
467 |
|
|
C-Cl |
346 |
|
|
C-Br |
290 |
|
|
C-I |
228 |
Pada semua reaksi substitusi nukleofilik, ikatan karbon-halogen harus
diputus pada beberapa titik selama reaksi terjadi. Semakin sulit ikatan
tersebut diputus, semakin lambat reaksi yang akan berlangsung.
Ikatan karbon-fluorin sangat kuat (lebih kuat dari ikatan C-H) dan tidak
mudah diputus. Ini berarti bahwa ikatan karbon-fluorin memiliki
polaritas yang paling besar, tetapi polaritas ini tidak penting sebab
kekuatan ikatan jauh lebih penting dalam menentukan kereaktifannya.
Dengan demikian fluoroalakana sangat tidak reaktif. Untuk pembahasan
selanjutnya kita tidak akan menyinggung lagi tentang fluoroalkana.
Pada halogenalkana yang lain, ikatan menjadi semakin lemah dari klorin ke bromin sampai ke iodin.
Ini berarti bahwa kloroalkana bereaksi paling lambat, bromoalkana
bereaksi paling cepat, dan iodoalkana bereaksi masih lebih cepat lagi.
Laju reaksi: RCl < RBr < RI
Dimana “<” dibaca sebagai “lebih kecil dari” – atau, dalam hal ini, “lebih rendah dari”, dan R merupakan gugus alkil.
Substitusi nukleofilik pada halogenalkana primer
Hal ini perlu diketahui dalam pembahasan tentang “halogenalkana primer” atau reaksi SN2.
Nukleofil
Nukleofil adalah sebuah spesies (ion atau molekul) yang tertarik
dengan kuat ke sebuah daerah yang bermuatan positif pada sesuatu yang
lain.
Nukleofil bisa berupa ion-ion negatif penuh, atau memiliki muatan yang
sangat negatif pada suatu tempat dalam sebuah molekul.
Nukleofil-nukleofil yang umum antara lain ion hidroksida, ion sianida,
air dan amonia.
Perhatikan bahwa masing-masing nukleofil pada gambar di atas
mengandung sekurang-kurangnya satu pasangan elektron bebas, baik pada
sebuah atom yang bermuatan negatif penuh, atau pada sebuah atom yang
sangat elektronegatif yang membawa muatan  - yang cukup besar.
- yang cukup besar.
Reaksi substitusi nukleofilik – sebuah reaksi SN2
Kita akan membahas mekanisme reaksi ini dengan menggunakan sebuah ion
sebagai nukleofil, karena akan lebih mudah. Mekanisme untuk nukleofil
air dan amonia melibatkan tahapan ekstra yang akan dijelaskan pada
halaman yang lain.
 Kita
akan mengambil contoh bromoetana sebagai sebuah halogenalkana primer
sederhana. Bromoetana memiliki sebuah ikatan polar antara karbon dan
bromin.
Kita
akan mengambil contoh bromoetana sebagai sebuah halogenalkana primer
sederhana. Bromoetana memiliki sebuah ikatan polar antara karbon dan
bromin.
Kita akan melihat reaksinya dengan menggunakan ion nukleofil yang umum, yang dalam hal ini kita sebut sebagai Nu-. Nukleofil ini akan memiliki sekurang-kurangnya satu pasangan elektron bebas. Nu- misalnya bisa berupa OH- atau CN-.

Pasangan elektron bebas pada ion Nu- akan tertarik kuat ke atom karbon  +,
dan akan bergerak ke arahnya, dan mulai membentuk sebuah ikatan
koordinasi (kovalen datif). Dalam proses ini, elektron dalam ikatan C-Br
akan terdorong lebih dekat ke arah bromin, sehingga membuatnya semakin
negatif.
+,
dan akan bergerak ke arahnya, dan mulai membentuk sebuah ikatan
koordinasi (kovalen datif). Dalam proses ini, elektron dalam ikatan C-Br
akan terdorong lebih dekat ke arah bromin, sehingga membuatnya semakin
negatif.
Pergerakan elektron bebas ini ke arah atom karbon akan terus berlangsung
sampai -Nu terikat kuat dengan atom karbon, dan bromin telah dilepaskan
sebagai sebuah ion Br-.
Hal-hal yang perlu diperhatikan
Ion Nu- mendekati atom karbon  +
dari sisi yang jauh dari atom bromin. Atom bromin yang besar
menghalangi serangan dari sisi yang berdekatan dengannya dan, karena
bermuatan
+
dari sisi yang jauh dari atom bromin. Atom bromin yang besar
menghalangi serangan dari sisi yang berdekatan dengannya dan, karena
bermuatan  -, akan menolak Nu-
yang mendekat. Serangan dari belakang ini penting jika anda ingin
memahami mengapa halogenalkana tersier memiliki mekanisme yang berbeda.
Kita akan membahas hal ini selanjutnya di halaman ini.
-, akan menolak Nu-
yang mendekat. Serangan dari belakang ini penting jika anda ingin
memahami mengapa halogenalkana tersier memiliki mekanisme yang berbeda.
Kita akan membahas hal ini selanjutnya di halaman ini.
Jika dicermati, maka harus ada sebuah titik dimana Nu- terikat setengah ke atom karbon, dan ikatan C-Br terputus setengahnya. Ini disebut sebagai keadaan transisi.
Keadaan ini bukan sebuah intermediet dan tidak bisa diamati terpisah
meski hanya sesaat. Keadaan ini hanyalah titik-tengah dari sebuah
serangan oleh satu gugus dan terlepasya gugus yang lain.
Cara menuliskan mekanisme reaksi
Cara yang paling sederhana adalah sebagai berikut:
Secara teknis, reaksi ini disebut sebagai reaksi SN2. S adalah singkatan dari substitusi, N singkatan untuk nukleofilik, dan dituliskan 2 karena tahap awal dari reaksi ini melibatkan dua spesies – yaitu bromoetana dan ion Nu-. Dalam beberapa silabus, reaksi ini biasa hanya disebut substitusi nukleofilik.
Dalam beberapa soal ujian, anda biasanya diminta menunjukkan keadaan
transisi ini dalam mekanisme reaksi, dimana anda perlu menuliskannya
dengan sedikit lebih mendetail, yaitu dengan menunjukkan bagaimana
segala sesuatunya tertata dalam ruang.
Berhati-hatilah saat anda menggambarkan keadaan transisi ini untuk
memperjelas perbedaan antara garis putus-putus yang menunjukkan ikatan
setengah-jadi dan setengah-putus, dengan yang menunjukkan ikatan-ikatan
yang sebenarnya.
Perhatikan bahwa molekul telah dibalik selama reaksi terjadi – agak mirip dengan payung yang terbuka ke atas.
Substitusi nukleofilik pada halogenalkana tersier
 Perlu
diingat bahwa sebuah halogenalkana tersier memiliki tiga gugus alkil
yang terikat pada atom karbon yang memiliki halogen. Gugus-gugus alkil
ini bisa sama atau berbeda, tapi disini kita hanya akan membahas yang
sederhana, yaitu gugus (CH3)3CBr (2-bromo-2-methylpropane).
Perlu
diingat bahwa sebuah halogenalkana tersier memiliki tiga gugus alkil
yang terikat pada atom karbon yang memiliki halogen. Gugus-gugus alkil
ini bisa sama atau berbeda, tapi disini kita hanya akan membahas yang
sederhana, yaitu gugus (CH3)3CBr (2-bromo-2-methylpropane).
Reaksi substitusi nukleofilik – sebuah reaksi SN1
Sekali lagi, kita akan membahas mekanisme ini dengan menggunakan
sebuah ion sebagai nukleofil, karena lebih mudah, dan lagi-lagi kita
akan melihat reaksi ion nukleofilik yang kita sebut sebagai Nu-. Ion nukleofil ini akan memiliki sekurang-kurangnya satu pasangan elektron bebas.
Mengapa sebuah mekanisme berbeda diperlukan?
Seperti yang telah dijelaskan bahwa ketika sebuah nukleofil menyerang
sebuah halogenalkana primer, dia akan mendekati atom karbon  + dari sisi yang jauh dari atom halogen.
+ dari sisi yang jauh dari atom halogen.
Pada halogenalkana tersier, hal ini tidak mungkin. Belakang molekul telah terisi oleh gugus-gugus CH3.
Karena serangan nukleofil dari arah lain tidak bisa terjadi akibat
adanya atom bromin, maka reaksi harus berlangsung dengan sebuah
mekanisme alternatif.
Mekanisme alternatif
Reaksi terjadi dalam dua tahapan. Pada tahap pertama, beberapa
halogenalkana terionisasi menghasilkan sebuah ion karbonium dan sebuah
ion bromida.
Reaksi ini mungkin karena karbonium tersier relatif stabil
dibandingkan dengan yang sekunder atau primer. Bahkan demikian, reaksi
tetap lambat.
Akan tetapi, ketika karbonium terbentuk, dia akan bereaksi segera ketika bersentuhan dengan sebuah nukleofil seperti Nu-.
Pasangan elektron bebas pada nukleofil tertarik kuat ke arah karbon
positif, dan bergerak kearahnya untuk membentuk sebuah ikatan baru.
Kecepatan reaksi akan ditentukan oleh seberapa cepat halogenalkana
terionisasi. Karena tahapan awal yang lambat ini hanya melibatkan satu
spesies, maka mekanisme ini disebut sebagai SN1 – substitusi, nukleofilik, satu spesies yang terlibat dalam tahap awal yang lambat.
Mengapa halogenalkana primer tidak menggunakan mekanisme SN1?
Jika sebuah halogenalkana primer menggunakan mekanisme ini, maka tahap pertama akan menjadi, misalnya:
Sebuah karbonium primer akan terbentuk, dan karbonium primer ini jauh
lebih tidak stabil dari segi energi dibanding karbonium tersier yang
terbentuk dari halogenalkana tersier – dan dengan demikian jauh lebih
sulit dihasilkan.
Ketidakstabilan ini berarti bahwa dibutuhkan energi aktivasi yang sangat
tinggi untuk reaksi yang melibatkan sebuah halogenalkana primer. Energi
aktivasi jauh lebih kecil jika mengalami reaksi SN2 – olehnya itu reaksi inilah yang terjadi.
Substitusi nukleofilik pada halogenalkana sekunder
 Tidak
ada mekanisme baru pada jenis halogenalkana ini. Halogenalkana sekunder
akan menggunakan kedua mekanisme – beberapa molekul akan bereaksi
menggunakan mekanisme SN2 dan yang lainnya menggunakan SN1.
Tidak
ada mekanisme baru pada jenis halogenalkana ini. Halogenalkana sekunder
akan menggunakan kedua mekanisme – beberapa molekul akan bereaksi
menggunakan mekanisme SN2 dan yang lainnya menggunakan SN1.
Mekanisme SN2 mungkin karena belakang molekul tidak semuanya
ditempati gugus alkil sehingga nukleofil yang mendekat masih bisa
terikat pada atom karbon  +.
+.
Mekanisme SN1 mungkin karena karbonium sekunder yang
terbentuk pada tahap lambat lebih stabil dibanding karbonium primer. Ion
karbonium ini tidak sama stabilnya dengan karbonium tersier, sehingga
rute SN1 tidak sama efektifnya dengan yang terjadi pada halogenalkana tersier.










 Dalam
keadaan padat, senyawa ionis terdapat dalam bentuk kristal dengan
susunan tertentu. Penafsiran terhadap hasil difraksi sinar-X pada
senyawa ion dapat memberi petunjuk mengenai susunan internal dari
kristal ion tersebut. Misalnya pada kristal NaCl dapat diketahui bahwa
setiap ion Na+ dikelilingi oleh 6 ion Cl-, dan setiap ion Cl- juga
dikelilingi oleh 6 ion Na+.
Dalam
keadaan padat, senyawa ionis terdapat dalam bentuk kristal dengan
susunan tertentu. Penafsiran terhadap hasil difraksi sinar-X pada
senyawa ion dapat memberi petunjuk mengenai susunan internal dari
kristal ion tersebut. Misalnya pada kristal NaCl dapat diketahui bahwa
setiap ion Na+ dikelilingi oleh 6 ion Cl-, dan setiap ion Cl- juga
dikelilingi oleh 6 ion Na+.
 Pada
table 1.1 dapat dilihat daya hantar berbagai senyawa klorida dalam
keadaan padatan, cair (meleleh) pada suhu titik lelehnya dan pada
larutannya
Pada
table 1.1 dapat dilihat daya hantar berbagai senyawa klorida dalam
keadaan padatan, cair (meleleh) pada suhu titik lelehnya dan pada
larutannya Pada
umumnya senyawa ionis larut dalam pelarut yang mengandung gugs OH-
seperti H2O dan C2H5OH yang merupakan senyawa kovalen polar, sedangkan
senyawa kovalen larut dalam pelarut nonpol
Pada
umumnya senyawa ionis larut dalam pelarut yang mengandung gugs OH-
seperti H2O dan C2H5OH yang merupakan senyawa kovalen polar, sedangkan
senyawa kovalen larut dalam pelarut nonpol













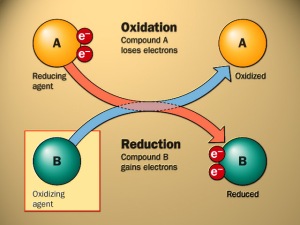





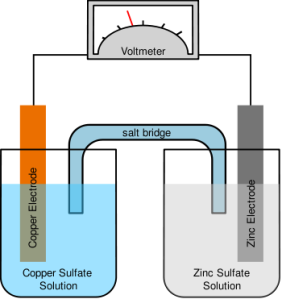

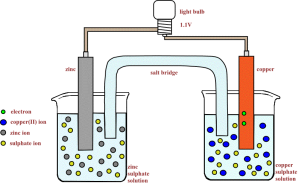



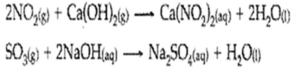
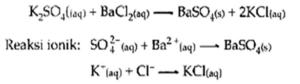


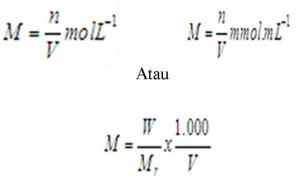
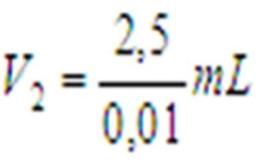




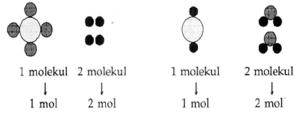






0 komentar: